

DCT模式与传统模式下临床试验编盲和药品管理的流程区别和优势
继2024年07月05日分享的有关DCT 在国内应用的现状,优势和挑战后,这一期我们近一步基于2024年6月13日至14日CMAC会议所传达的信息和精神,介绍DCT模式下,有别于传统模式下临床试验编盲和药品管理的流程。
DCT设计的法规支持ICH GCP E6(R3)规范支持创新的数字健康技术等有效的试验设计和实施方法,如可穿戴设备和传感器。这些技术可以整合到现有的医疗保健基础设施中,使得更广泛的数据源可以在临床中得以应用,更前沿的科学技术得以同步至临床试验的实施过程中,扩展试验实施的方式。本原则允许根据不同文件的用途选择相应的技术手段进行记录。在DCT模式下,利用计算机和数字技术实现临床试验盲态、药品相关流程实施的管理,相较于传统模式下临床试验的操作能极大提高工作效率。
在传统模式下,我国临床试验用药主要靠人工记录方法进行管理。由于临床试验药品管理的全周期中涉及到用药准备、分组、患者用药、药品回收至研究中心销毁和回收至申办方销毁等流程中的相关环节、人员和场所是多样的,交叉的以及复杂的。在这些过程中,各部分记录的信息割裂,难以实现系统化管理、实时监测和全程追溯。另外,一些临床试验管理系统中虽然包含药品管理的功能和模块,但主要集中于管理药品出库,运输,入库,发放,储存的个主要环节,无法实现实时以及最小药品包装单位的全流程监控和追溯,从而无法满足临床试验药品的管理过程书面记录,全过程准确计数的要求。
对此,国家药品监督管理局药品评审中心试行的《药物临床试验盲法指导原则》中鼓励将新技术应用于盲法,从而提高盲法实施的质量和效率。该指导原则中指出“将追溯码、加密技术和区块链技术等与中央随机化系统结合起来替代传统的分配隐藏和药物编码等设盲措施,也可结合现代物流和物联网技术将试验用药品直接送达受试者以减少或消除传统药物管理过程中存在的意外破盲风险”。
DCT模式使得“药品追溯码”用于临床试验用药物编盲成为可能。在这种模式下,临床试验用药追溯码生成后,可实现药物属性加密,大中小包装关联,并与其他第三方系统对接。在临床试验药品出库,收货,使用等环节中均可利用追溯码实现下图[1]中临床试验用药的精准追踪。
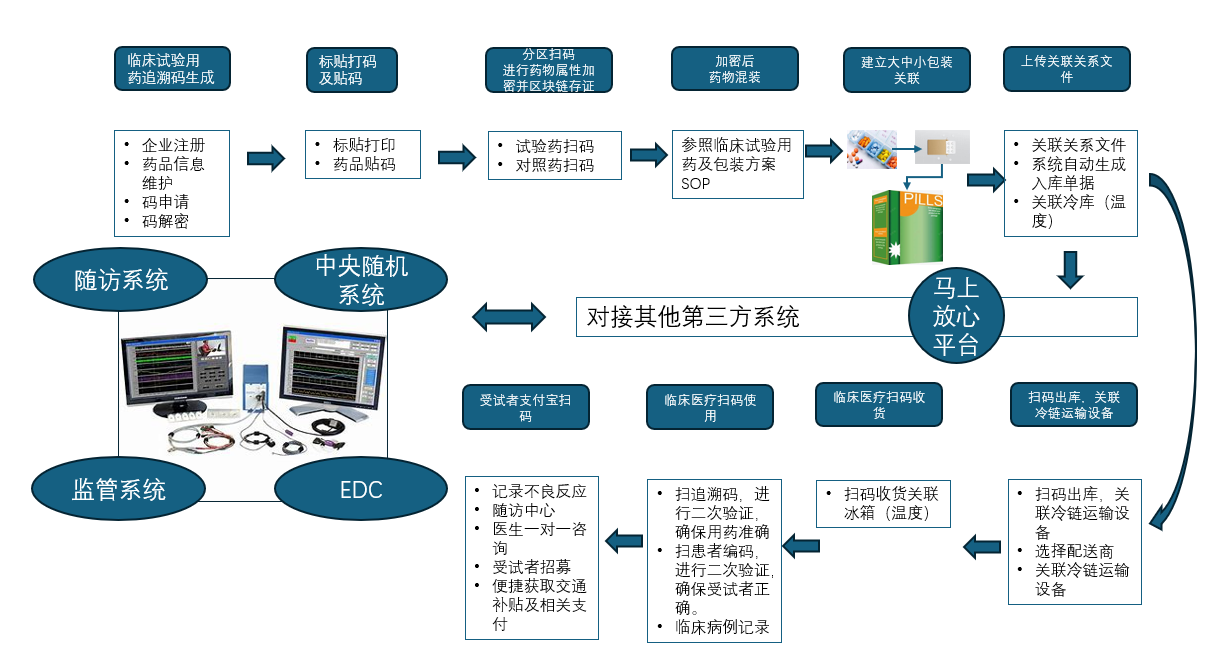
整体上,“药品追溯码”临床试验用药编盲对于申办方、试验中心、服务供应商、受试者和监管方均有一定价值,举例如下:
申办方:
试验中心:
服务供应商:
受试者:
监管方
综上所述,DCT药物管理与现行管理相比,在药物配送、储存和使用、数据安全和隐私保护等方面都提出了更高的要求。如何优化和完善现行管理体系,加强对DCT药物管理的监管和指导,确保DCT的顺利开展和受试者的权益保护,则是我们面临的新的挑战。
参考文献:
[1]阎小妍,高灵灵,姚晨.药品追溯码:从上市后药品监管到上市前临床试验用药管理的应用研究[J].中国食品药品监管,2020,(11)。
声明:原创内容的最终解释权以及版权归晓通明达所有,欢迎转发。如需转载文章,请联系bd@hannah-associates.com。
作者简介
Real Yuan(袁珍)
拥有12年行业经验,其中QA经验8年。现任晓通明达质量经理,专注于GCP领域稽查。
2024-08-20