在上篇文章中,我们对中国药物临床试验监管相关法律法规体系进行了概述,本次将对中国医疗器械(含体外诊断试剂)临床试验监管相关法规体系进行概述。
一, 首先,我们将明确医疗器械的定义:
医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
(一)疾病的诊断、预防、监护、治疗或者缓解;
(二)损伤的诊断、监护、治疗、缓解或者功能补偿;
(三)生理结构或者生理过程的检验、替代、调节或者支持;
(四)生命的支持或者维持;
(五)妊娠控制;
(六)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
二, 什么是医疗器械临床试验呢?
医疗器械临床试验,是指在符合条件的医疗器械临床试验机构中,对拟申请注册的医疗器械(含体外诊断试剂)在正常使用条件下的安全性和有效性进行确认的过程。
三, 是否是所有的医疗器械,都需要进行临床试验呢?
国家对医疗器械按照风险程度实行分类管理。第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。并非所有的医疗器械都要进行临床试验,第三类医疗器械临床试验对人体具有较高风险的,应当经国务院药品监督管理部门批准。国家药品监督管理局根据申请人的申请,综合分析,以决定是否同意开展临床试验。
下图将展示医疗器械分类与管理:

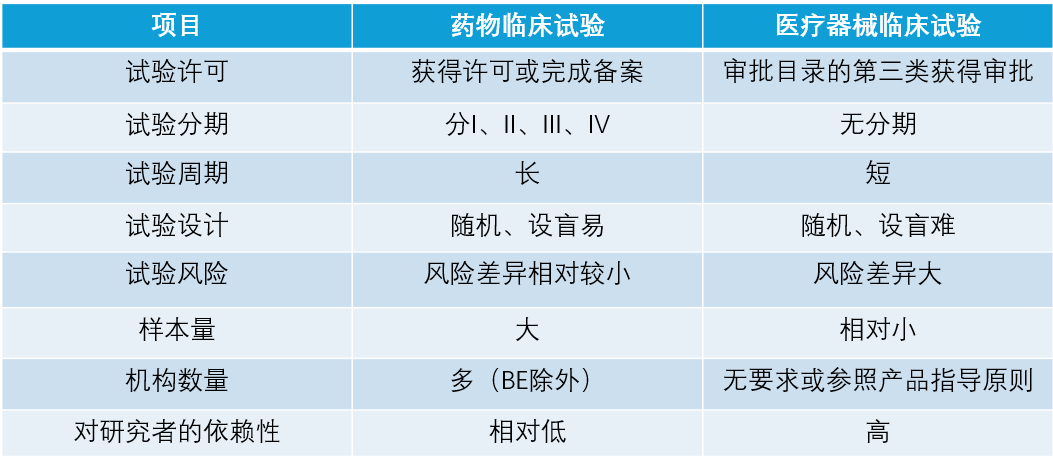
四, 药物临床试验与医疗器械临床试验的特点及不同:
五, 在进行以上对于医疗器械的相关介绍之后,我们将重点对中国医疗器械(含体外诊断试剂)临床试验监管相关法规体系进行概述。
与药物临床试验一样,在中国医疗器械临床试验也受到一系列复杂而全面的法规体系的监管,这一体系包括不同层次的法规、规章、规范性文件和技术性指导原则。本文将按法律位阶,概述这些相关法规的名称、发布机构和常见法规,以提供对医疗器械临床试验法规体系的全面理解。
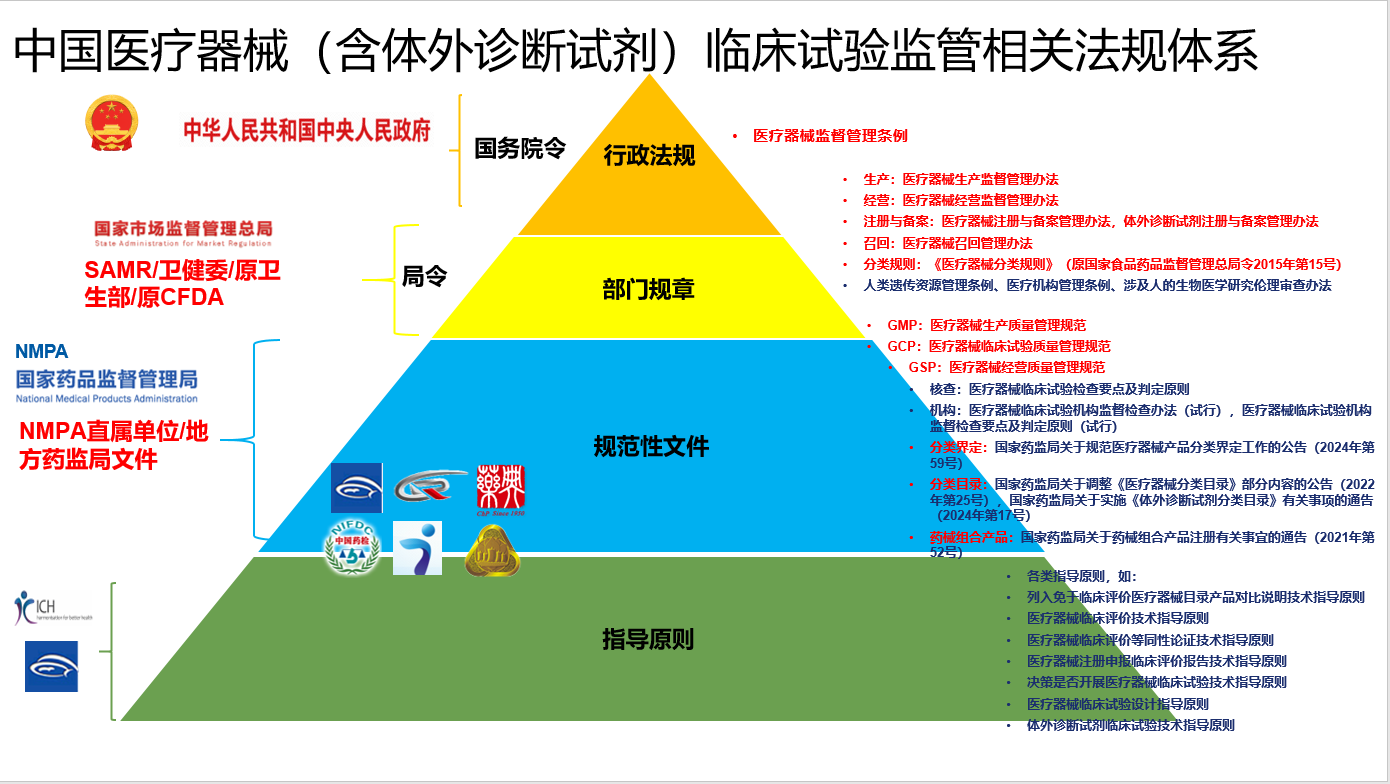
1,行政法规
- 制订:国务院根据宪法和法律制定
- 发布:行政法规由总理签署国务院令公布
- 名称:一般称“条例”,也可以称“规定”、“办法”等
- 《医疗器械监督管理条例》(国务院令第739号)
- 《中华人民共和国人类遗传资源管理条例》(国务院令第717号)
- 备注:与药物临床试验的监管不同的是,医疗器械临床试验的监管法规体系中,最高层级为行政法规。
2,部门规章
- 制订:国务院各部、委员会、中国人民银行、审计署和具有行政管理职能的直属机构(国务院部、委、行、署、直属机构)在本部门的权限范围内制定规章
- 发布:部门规章由部门首长签署命令予以公布
- 名称:规章的名称一般称“规定”、“办法”、“实施细则”,但不得称“条例”、“通知”
- 生产:《医疗器械生产监督管理办法》(市场监管总局令2022年第53号)
- 注册与备案:《医疗器械注册与备案管理办法》(市场监管总局令2021年第47号),《体外诊断试剂注册与备案管理办法》(市场监管总局令2021年第48号)
- 经营:《医疗器械经营监督管理办法》(市场监管总局令2022年第54号)
- 分类规则:《医疗器械分类规则》(原国家食品药品监督管理总局令2015年第15号)
- 伦理:《涉及人的生物医学研究伦理审查办法》(2016年原卫计委)
3,规范性文件-行政规范性文件
- 名称:行政规范性文件,一般为规范,指南,通知,公告,解读。
- GMP:《医疗器械生产质量管理规范》(原国家食品药品监督管理总局2014年第64号)
- GCP:《医疗器械临床试验质量管理规范》(国家药品监督管理局 国家卫生健康委员会2022年第28号公告)
- GSP:《医疗器械经营质量管理规范》(国家药监局2023年第153号公告)
- 核查:《医疗器械临床试验检查要点及判定原则》(药监综械注〔2018〕45号 )
- 临床试验机构:《医疗器械临床试验机构监督检查办法(试行)》(国家药监局2024年第22号通告),《医疗器械临床试验机构监督检查要点及判定原则(试行)》(CFDI 2024年第4号通告)
- 分类界定:国家药监局关于规范医疗器械产品分类界定工作的公告(2024年第59号)
- 分类规则:《体外诊断试剂分类规则》(国家药品监督管理局2021年第129号公告)
- 分类目录:国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第25号),总局关于发布医疗器械分类目录的公告(原食品药品监管总局2017年第104号);国家药监局关于实施《体外诊断试剂分类目录》有关事项的通告(2024年第17号),国家药监局关于发布体外诊断试剂分类目录的公告(2024年第58号)
- 药械组合产品:国家药监局关于药械组合产品注册有关事宜的通告(2021年第52号)
4,技术性指导原则
- 指导性文件仅供参考,不具有强制执行效力。与医疗器械相关的技术性指导原则,举例如下:
- 《列入免于临床评价医疗器械目录产品对比说明技术指导原则》(国家药品监督管理局2021年第73号公告);
- 《医疗器械临床评价技术指导原则》(国家药品监督管理局2021年第73号公告)
- 《医疗器械临床评价等同性论证技术指导原则》(国家药品监督管理局2021年第73号公告)
- 《医疗器械注册申报临床评价报告技术指导原则》(国家药品监督管理局2021年第73号公告)
- 《决策是否开展医疗器械临床试验技术指导原则》(国家药品监督管理局2021年第73号公告);
- 《医疗器械临床试验设计指导原则》(2018年第6号);
- 《体外诊断试剂临床试验技术指导原则》(国家药品监督管理局2021年第72号公告);
- 《医疗器械临床试验数据递交要求注册审查指导原则》(2021年第91号);
- 《体外诊断试剂临床试验数据递交要求注册审查指导原则》(2021年第91号);
六,其他相关法律法规
- 《中华人民共和国刑法》
- 《中华人民共和国行政许可法》
- 《中华人民共和国行政处罚法》
- 《中华人民共和国生物安全法》
- 《中华人民共和国民法典》
- 《中华人民共和国个人信息保护法》
- 《中华人民共和国数据安全法》
- 《中华人民共和国科学技术进步法》
- ……
涵盖了从刑事责任、民事责任、合同关系到个人信息保护的广泛内容,对于临床试验中可能涉及的各种法律问题提供了全面的法律依据。
七,结论
医疗器械临床试验法规体系不仅保护了公众健康,还促进了医疗器械产业的进步和发展。这些法规确保了临床试验的质量、效率和透明度,为医疗器械的安全性和有效性提供了坚实的法律保障。
声明:原创内容的最终解释权以及版权归晓通明达所有,欢迎转发。如需转载文章,请联系bd@hannah-associates.com。
作者简介
拥有12年行业经验,其中QA经验4年。现任晓通明达质量经理,专注于GCP领域稽查。




