药物临床试验是新药研发过程中的关键环节,旨在评估药物的安全性、有效性及确定其适用范围。在全球范围内,药物临床试验受到严格监管,确保研究符合伦理标准,保护受试者权益,并保证数据的真实性和可靠性。同样在中国,药物临床试验受到一系列复杂而全面的法规体系的监管,这一体系包括不同层次的法律、行政法规、部门规章、规范性文件和技术性指导原则。本文将按法律位阶,概述这些法规的名称、发布机构和常见法规,以提供对药物临床试验法规体系的全面理解。
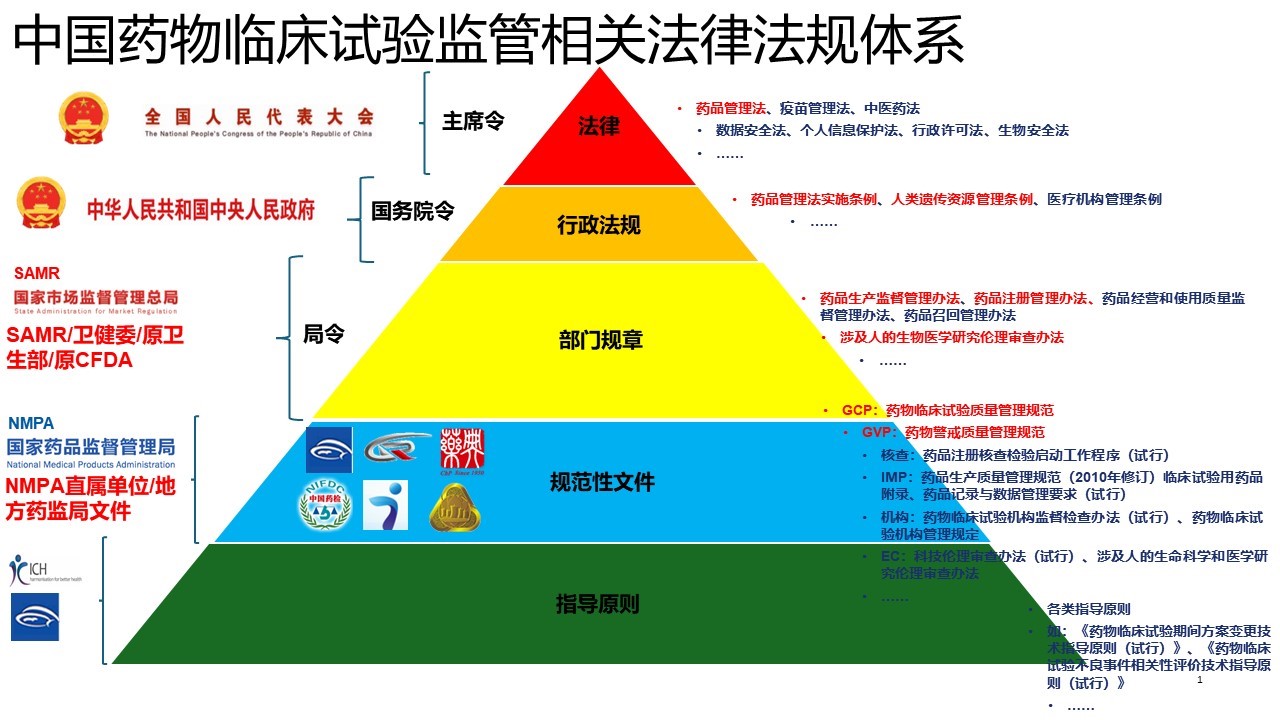
一、法律
- 制订:全国人大及其常委会制定
- 发布:全国人民代表大会通过的法律由国家主席签署主席令予以公布
- 名称:XX法
- 《中华人民共和国药品管理法》(2019年修订)
- 《中华人民共和国疫苗管理法》(2019年)
二、行政法规
- 制订:国务院根据宪法和法律制定
- 发布:行政法规由总理签署国务院令公布
- 名称:一般称“条例”,也可以称“规定”、“办法”等,《中华人民共和国药品管理法实施条例》、《中华人民共和国人类遗传资源管理条例》国令第717号
- 备注:地方性法规(地方人大及其常委会制定),行政法规效力高于地方性法规
三、部门规章
- 制订:国务院各部、委员会、中国人民银行、审计署和具有行政管理职能的直属机构(国务院部、委、行、署、直属机构)在本部门的权限范围内制定规章
- 发布:部门规章由部门首长签署命令予以公布
- 名称:规章的名称一般称“规定”、“办法”、“实施细则”,但不得称“条例”、“通知”。
- 生产:《药品生产监督管理办法》(国家市场监督管理总局令2020年第28号),
- 注册:《药品注册管理办法》(国家市场监督管理总局令2020年第27号)
- 经营和使用:《药品经营和使用质量监督管理办法》国家市场监督管理总局令第84号、《涉及人的生物医学研究伦理审查办法》(2016年卫计委)
四、规范性文件
- 分类:规范性文件分:广义规范性文件和狭义规范性文件。
- 广义规范性文件:属于法律范畴的立法性文件即宪法、法律、法规(行政法规、地方性法规)、规章(部门规章、地方政府规章)+行政规范性文件。
- 狭义规范性文件即行政规范性文件 。
- 行政规范性文件:行政规范性文件是除国务院的行政法规、决定、命令以及部门规章和地方政府规章外,由行政机关或者经法律、法规授权的具有管理公共事务职能的组织(以下统称行政机关)依照法定权限、程序制定并公开发布,涉及公民、法人和其他组织权利义务,具有普遍约束力,在一定期限内反复适用的公文。也就是大家常说的“红头文件”。
- 名称:行政规范性文件,一般为规范,指南,通知,公告,解读。
- GCP:《药物临床试验质量管理规范》(国家药监局 国家卫生健康委2020年第57号公告)
- GVP:《药物警戒质量管理规范》(国家药品监督管理局2021年第65号)
- 核查:《药品注册核查检验启动工作程序(试行)》(国家药品监督管理局药品审评中心2021年第54号);《药品注册核查工作程序(试行)》(国家药品监督管理局药品审评中心2021年第30号)
五、技术性指导原则
- 技术性指导原则,属于指导性文件。是指用于上级机关或有关主管部门阐述和说明开展某项工作的基本思想、原则、要求,并对工作进行原则性指导的文件。
- 指导性文件仅供参考,不具有强制执行效力。
- 包括普适的,公共部分的;与具体产品有关的。也可分为国内相关技术指导原则,国际相关技术指导原则(如ICH、FDA、EMA)。
- 《局部给药局部起效药物临床试验技术指导原则》(国家药监局药审中心2022年第32号)
- 《药物临床试验期间方案变更技术指导原则(试行)》(国家药监局药审中心2022年第34号)
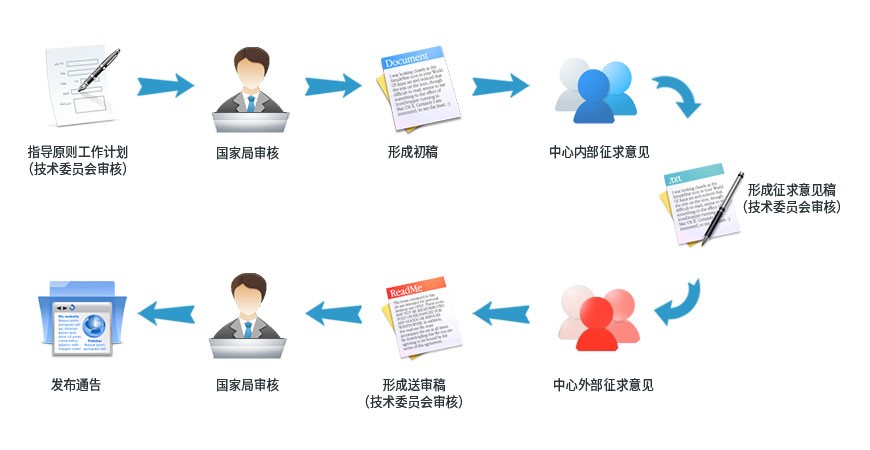
- 指导原则制定流程(来源于CDE官网)
六、其他相关法律法规
《中华人民共和国刑法》
《中华人民共和国行政许可法》
《中华人民共和国行政处罚法》
《中华人民共和国生物安全法》
《中华人民共和国民法典》
《中华人民共和国个人信息保护法》
《中华人民共和国数据安全法》
《中华人民共和国科学技术进步法》
等涵盖了从刑事责任、民事责任、合同关系到个人信息保护的广泛内容,对于临床试验中可能涉及的各种法律问题提供了全面的法律依据。
七、结论
药物临床试验的法规体系是多层次、全方位的,覆盖了从最高级别的国家法律到具体的操作指导原则。这一体系确保了临床试验的科学性、安全性和伦理合法性,同时保护了受试者的权益。对于所有参与临床试验的机构和个人而言,了解并遵守这些法律法规是基本要求,也是推动医药行业健康发展的基石。随着法律法规的持续更新和完善,及时掌握最新政策动态,确保临床试验的合规性,对于加速新药研发进程具有重要意义。
拥有12年行业经验,其中QA经验4年。现任晓通明达质量经理,专注于GCP领域稽查。



